 |

|
|
 |
|
|
|
| |
Regelwerk DIN EN ISO 13485:2021/2021 - Medizinprodukte Produktion & Dienstleistung
Letzte Aktualisierung September 2022
Um auch eine Zertifizierung nach ISO 9001 zu realisieren, haben wir ein ergänzendes Verzeichnis eingefügt.
Wer braucht die Vorlage DIN EN ISO 13485:2021/2021 - Medizinprodukte Produktion & Dienstleistung?
Zielgruppe:
- Produzenten von Medizinprodukten oder Teilen davon ohne eigene Inverkehrbringung eines Medizinproduktes
- Veredler von Medizinprodukten wie Beschichtung...
- Dienstleister für Medizinproduktehersteller wie Schulung, Installation, Wartung und vieles mehr.
Die Norm behält die Struktur mit 8 Kapiteln
Gliederung Verzeichnisse:
- Handbuch (8 Kapitel),
- Prozessbeispiele (60),
- Anweisungsbeispiele (8),
- Formblätter / Nachweisvorlagen (55)
- ISO 13485 Zusatz zur ISO 9001
Die Nummerierung entspricht der zugrundeliegenden Norm DIN EN ISO 13485:2021 . So kann eine Zuordnung zur Norm leicht realisiert werden.
Unterschied zur Vorgängerversion:
- Es wird ausschließlich die Produktrealisierung und die Dienstleistung beachtet.
- Keine Berücksichtigung der MDR 745/2017
Konditionen:
- Keine Ergänzungslieferungen,
- Bezahlung per Rechnung oder PayPal.
- Lieferung per Download oder manuell durch uns
Besonderes:
- Wir haben die Formblätter und Nachweisformen mit Beispielen gefüllt. Dies vereinfacht die Erstellung und Anpassung.
- Die Disziplinen Produktion, Vertrieb und Dienstleistung sind beachtet (keine Entwicklung).
- Die Struktur des Regelwerkes richtet sich nach der Norm: Das bedeutet, dass alle Dokumente nach dem entsprechenden Normpunkt nummeriert sind.
- Der Aufwand zur Anpassung des Regelwerkes unter Beachtung von MS-Office Kenntnissen ist gering. Für Unternehmen mit bestehender Zertifizierung, dient das Regelwerk dazu den neuen Normforderungen gerecht zu werden.
ISBN bei Bestellung über den Buchhandel 978-3-947669-14-1 |
Downloads:
Kein Abo und keine kostenpflichtigen Ergänzungslieferungen!
 |
Alle Vorlagen können in MS-Office Programmen bearbeitet werden. |
|
| |
Preis: |
|
|
| |
112,00 € |
|
inkl. gesetzlicher MwSt.
|
| |
|
|
|
| |
 |
Verwandte Produkte
.
|
|
|
|
|
|
 
|
|
|
| |
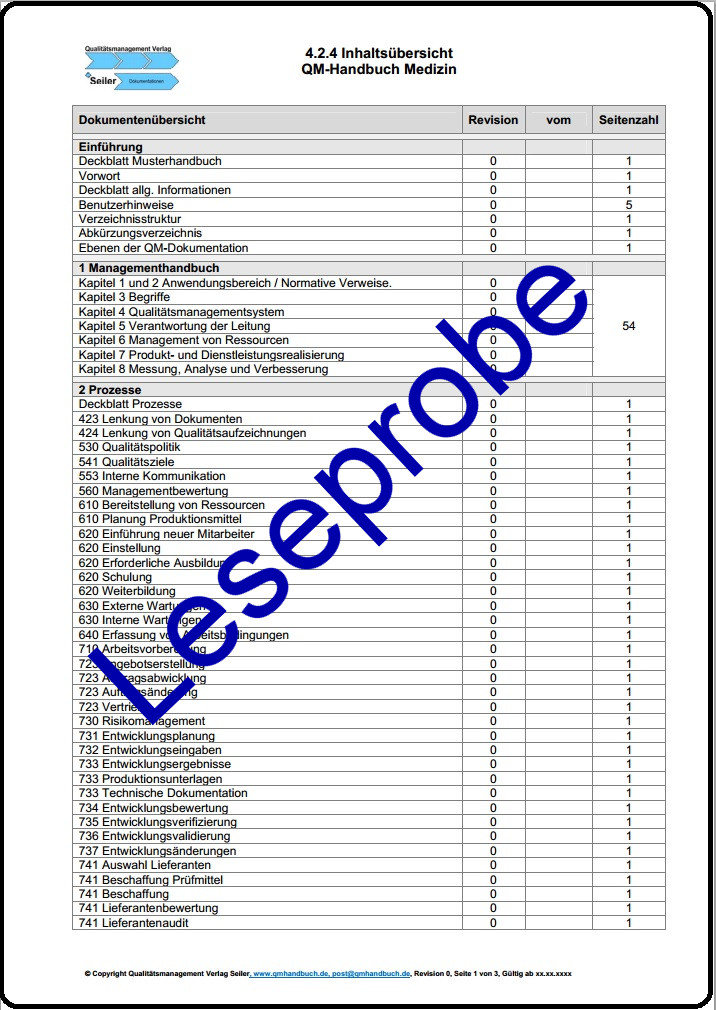
Inhalte Regelwerk
Strukturiert nach den 8 Kapiteln der Norm DIN EN ISO 13485:2021 |
|
|
|
|
|
|
|
 
|
|
|
| |
Informationen zum Autor
Klaus
Seiler, Master of science in quality management, berät Unternehmen bei
der Einführung, Weiterentwicklung und Umsetzung von Managementsystemen.
Er ist Autor von zahlreichen Musterhandbüchern auf unterschiedlichen
Normgrundlagen.Durch seine Erfahrungen als Berater, Sachverständiger,
Lead- oder Zertifizierungs-Auditor kennt er die Probleme der Unternehmen
bei der Umsetzung von Managementsystemen.
Die Musterdokumentationen sind das Ergebnis aus langjährigen Erfahrungen,
der Lehre und aus Beratungen. |
 |
|
|
|
|
|
|
|
|

